2018年12月アーカイブ
高濃度ビタミンC点滴はがん細胞のDNAを損傷し、NAD+とATPを枯渇して、細胞死を誘導する。
高濃度ビタミンC点滴はがん細胞のDNAを損傷し、NAD+とATPを枯渇して、細胞死を誘導する。
Pharmacologic ascorbate induces neuroblastoma cell death by hydrogen peroxide mediated DNA damage and reduction in cancer cell glycolysis.(薬理学的アスコルビン酸は過酸化水素介在性のDNA損傷とがん細胞の解糖系の抑制によって神経芽細胞腫に細胞死を誘導する)Free Radic Biol Med. 2017 Dec;113:36-47.
【要旨】
アスコルビン酸は酸化ストレスを高め、腫瘍の増殖を遅らせることが示されている。この作用において、解糖系の抑制が起こることが推測されている。この研究では、この観察に関連するメカニズムをさらに検討した。
アスコルビン酸は過酸化水素を産生し、その結果、ATP枯渇とGAPDH(グリセルアルデヒド-3-リン酸デヒドロゲナーゼ)の阻害を引き起こして、ヒト神経芽細胞腫を死滅させる作用を示し、アポトーシスやオートファジーによる細胞死とは異なるタイプの細胞死を引き起こす。
細胞傷害性の機序は、PARP(ポリADPリボースポリメラーゼ)依存性DNA修復機構が活性化される場合と阻害された場合では異なっていた。
アスコルビン酸によって生成された過酸化水素はDNAを損傷し、PARPを活性化し、酸化型NAD(NAD+)を枯渇し、解糖系を阻害した。
NAD+の補給は、ATP枯渇および細胞死を防止した。一方、PARP阻害剤のオラパリブ(olaparib)での処理は、NAD+およびATPレベルを維持したが、DNA二本鎖切断の増加をもたらし、アスコルビン酸誘発性細胞死を防止しなかった。
これらの実験結果は、正常なPARP関連DNA修復システムを有する細胞においては、アスコルビン酸誘導性細胞死はNAD+およびATP枯渇によって引き起こされるが、PARP活性が阻害された条件では、アスコルビン酸誘導性の細胞死は起こるが、それは活性酸素種によるDNA損傷の結果である。
マウス異種移植モデルでは、腹腔内に投与したアスコルビン酸は神経芽細胞腫の増殖を抑制し、生存期間を延長した。
以上をまとめると、これらのデータは、アスコルビン酸が解糖依存性腫瘍の治療に有効であり得ることを示唆している。また、解糖系以外の代替エネルギー代謝経路を使用するがんでは、PARP阻害剤をアスコルビン酸治療と組み合わせることが有用である。
【解説】
ビタミンCはグルコースと構造が似ており、同じ糖輸送担体(グルコーストランスポーター)によって細胞内に取込まれます。がん細胞はグルコーストランスポーターの発現量が増え、グルコースの取込みが亢進しているので、大量のビタミンCががん細胞に取込まれ、がん細胞が選択的に死滅させることができます。
提唱されている作用機序として、ビタミンCによって発生した過酸化水素(H2O2)がDNAにダメージを与えると、ポリADPリボース合成酵素(PARP)が活性化されNAD+が枯渇し、解糖系もTCA回路も進まなくなります。活性酸素はミトコンドリアにもダメージを与えます。これらの作用で、エネルギーが枯渇して細胞が死滅することになります。この作用機序を下図にまとめています。
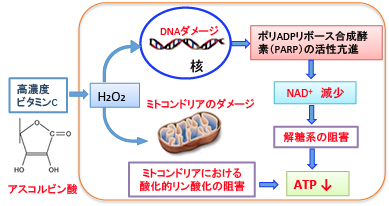
図:ビタミンCはグルコーストランスポーターから細胞内に取込まれる。がん細胞はグルコーストランスポーターの発現量が増えているので、がん細胞に高濃度のビタミンCが取込まれる。取込まれたビタミンCはがん細胞内で過酸化水素(H2O2)を発生させて、DNAとミトコンドリアにダメージを与える。DNAのダメージはポリADPリボース合成酵素(PARP)の活性を亢進してNAD+(ニコチンアミドアデニンジヌクレオチド)が減少すると解糖系が阻害される。ミトコンドリアのダメージは酸化的リン酸化でのATP産生を減少させる。この結果、がん細胞内のATPが枯渇してがん細胞は死滅する。
また、PARP阻害剤のオラパリブ(olaparib)と高濃度ビタミンC点滴の併用が有効であることが示唆されます。
高濃度ビタミンC点滴についてはこちらへ:
http://www.1ginzaclinic.com/vitamin.html
【原文】
Free Radic Biol Med. 2017 Dec;113:36-47.
Pharmacologic ascorbate induces neuroblastoma cell death by hydrogen
peroxide mediated DNA damage and reduction in cancer cell glycolysis.
Ma E, Chen P, Wilkins HM, Wang T, Swerdlow RH, Chen Q.
Abstract
An ascorbate-mediated production of oxidative stress has been shown to retard tumor growth. Subsequent glycolysis inhibition has been suggested. Here, we further define the mechanisms relevant to this observation. Ascorbate was cytotoxic to human neuroblastoma cells through the production of H2O2, which led to ATP depletion, inhibited GAPDH, and non-apoptotic and non-autophagic cell death. The mechanism of cytotoxicity is different when PARP-dependent DNA repair machinery is active or inhibited. Ascorbate-generated H2O2 damaged DNA, activated PARP, depleted NAD+, and reduced glycolysis flux. NAD+ supplementation prevented ATP depletion and cell death, while treatment with a PARP inhibitor, olaparib, preserved NAD+ and ATP levels but led to increased DNA double-strand breakage and did not prevent ascorbate-induced cell death. These data indicate that in cells with an intact PARP-associated DNA repair system, ascorbate-induced cell death is caused by NAD+ and ATP depletion, while in the absence of PARP activation ascorbate-induced cell death still occurs but is a consequence of ROS-induced DNA damage. In a mouse xenograft model, intraperitoneal ascorbate inhibited neuroblastoma tumor growth and prolonged survival. Collectively, these data suggest that ascorbate could be effective in the treatment of glycolysis-dependent tumors. Also, in cancers that use alternative energy metabolism pathways, combining a PARP inhibitor with ascorbate treatment could be useful.