がんの補完代替医療の最近のブログ記事
高濃度ビタミンC点滴はがん細胞のDNAを損傷し、NAD+とATPを枯渇して、細胞死を誘導する。
高濃度ビタミンC点滴はがん細胞のDNAを損傷し、NAD+とATPを枯渇して、細胞死を誘導する。
Pharmacologic ascorbate induces neuroblastoma cell death by hydrogen peroxide mediated DNA damage and reduction in cancer cell glycolysis.(薬理学的アスコルビン酸は過酸化水素介在性のDNA損傷とがん細胞の解糖系の抑制によって神経芽細胞腫に細胞死を誘導する)Free Radic Biol Med. 2017 Dec;113:36-47.
【要旨】
アスコルビン酸は酸化ストレスを高め、腫瘍の増殖を遅らせることが示されている。この作用において、解糖系の抑制が起こることが推測されている。この研究では、この観察に関連するメカニズムをさらに検討した。
アスコルビン酸は過酸化水素を産生し、その結果、ATP枯渇とGAPDH(グリセルアルデヒド-3-リン酸デヒドロゲナーゼ)の阻害を引き起こして、ヒト神経芽細胞腫を死滅させる作用を示し、アポトーシスやオートファジーによる細胞死とは異なるタイプの細胞死を引き起こす。
細胞傷害性の機序は、PARP(ポリADPリボースポリメラーゼ)依存性DNA修復機構が活性化される場合と阻害された場合では異なっていた。
アスコルビン酸によって生成された過酸化水素はDNAを損傷し、PARPを活性化し、酸化型NAD(NAD+)を枯渇し、解糖系を阻害した。
NAD+の補給は、ATP枯渇および細胞死を防止した。一方、PARP阻害剤のオラパリブ(olaparib)での処理は、NAD+およびATPレベルを維持したが、DNA二本鎖切断の増加をもたらし、アスコルビン酸誘発性細胞死を防止しなかった。
これらの実験結果は、正常なPARP関連DNA修復システムを有する細胞においては、アスコルビン酸誘導性細胞死はNAD+およびATP枯渇によって引き起こされるが、PARP活性が阻害された条件では、アスコルビン酸誘導性の細胞死は起こるが、それは活性酸素種によるDNA損傷の結果である。
マウス異種移植モデルでは、腹腔内に投与したアスコルビン酸は神経芽細胞腫の増殖を抑制し、生存期間を延長した。
以上をまとめると、これらのデータは、アスコルビン酸が解糖依存性腫瘍の治療に有効であり得ることを示唆している。また、解糖系以外の代替エネルギー代謝経路を使用するがんでは、PARP阻害剤をアスコルビン酸治療と組み合わせることが有用である。
【解説】
ビタミンCはグルコースと構造が似ており、同じ糖輸送担体(グルコーストランスポーター)によって細胞内に取込まれます。がん細胞はグルコーストランスポーターの発現量が増え、グルコースの取込みが亢進しているので、大量のビタミンCががん細胞に取込まれ、がん細胞が選択的に死滅させることができます。
提唱されている作用機序として、ビタミンCによって発生した過酸化水素(H2O2)がDNAにダメージを与えると、ポリADPリボース合成酵素(PARP)が活性化されNAD+が枯渇し、解糖系もTCA回路も進まなくなります。活性酸素はミトコンドリアにもダメージを与えます。これらの作用で、エネルギーが枯渇して細胞が死滅することになります。この作用機序を下図にまとめています。
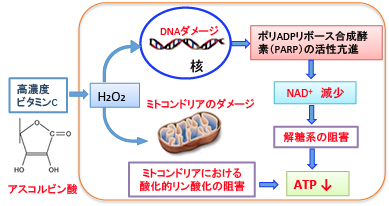
図:ビタミンCはグルコーストランスポーターから細胞内に取込まれる。がん細胞はグルコーストランスポーターの発現量が増えているので、がん細胞に高濃度のビタミンCが取込まれる。取込まれたビタミンCはがん細胞内で過酸化水素(H2O2)を発生させて、DNAとミトコンドリアにダメージを与える。DNAのダメージはポリADPリボース合成酵素(PARP)の活性を亢進してNAD+(ニコチンアミドアデニンジヌクレオチド)が減少すると解糖系が阻害される。ミトコンドリアのダメージは酸化的リン酸化でのATP産生を減少させる。この結果、がん細胞内のATPが枯渇してがん細胞は死滅する。
また、PARP阻害剤のオラパリブ(olaparib)と高濃度ビタミンC点滴の併用が有効であることが示唆されます。
高濃度ビタミンC点滴についてはこちらへ:
http://www.1ginzaclinic.com/vitamin.html
【原文】
Free Radic Biol Med. 2017 Dec;113:36-47.
Pharmacologic ascorbate induces neuroblastoma cell death by hydrogen
peroxide mediated DNA damage and reduction in cancer cell glycolysis.
Ma E, Chen P, Wilkins HM, Wang T, Swerdlow RH, Chen Q.
Abstract
An ascorbate-mediated production of oxidative stress has been shown to retard tumor growth. Subsequent glycolysis inhibition has been suggested. Here, we further define the mechanisms relevant to this observation. Ascorbate was cytotoxic to human neuroblastoma cells through the production of H2O2, which led to ATP depletion, inhibited GAPDH, and non-apoptotic and non-autophagic cell death. The mechanism of cytotoxicity is different when PARP-dependent DNA repair machinery is active or inhibited. Ascorbate-generated H2O2 damaged DNA, activated PARP, depleted NAD+, and reduced glycolysis flux. NAD+ supplementation prevented ATP depletion and cell death, while treatment with a PARP inhibitor, olaparib, preserved NAD+ and ATP levels but led to increased DNA double-strand breakage and did not prevent ascorbate-induced cell death. These data indicate that in cells with an intact PARP-associated DNA repair system, ascorbate-induced cell death is caused by NAD+ and ATP depletion, while in the absence of PARP activation ascorbate-induced cell death still occurs but is a consequence of ROS-induced DNA damage. In a mouse xenograft model, intraperitoneal ascorbate inhibited neuroblastoma tumor growth and prolonged survival. Collectively, these data suggest that ascorbate could be effective in the treatment of glycolysis-dependent tumors. Also, in cancers that use alternative energy metabolism pathways, combining a PARP inhibitor with ascorbate treatment could be useful.
ジクロロ酢酸とCOX-2阻害剤のセレコックス(celecoxib)の併用は相乗的な抗腫瘍効果を示す
ジクロロ酢酸とCOX-2阻害剤のセレコックス(celecoxib)の併用は相乗的な抗腫瘍効果を示す
Inhibition of COX2 enhances the chemosensitivity of dichloroacetate in cervical cancer cells(シクロオキシゲナーゼ2の阻害は子宮頚がん細胞におけるジクロロ酢酸の感受性を増強する)Oncotarget. 2017 Aug 1; 8(31): 51748-51757.
【要旨】
ミトコンドリア機能を高めるジクロロ酢酸は、子宮頚がんを含む多くの悪性腫瘍の治療において、抗がん剤感受性を高める増感剤として有望な可能性を示している。しかし、子宮頚がんに対するジクロロ酢酸単独の効果については不明である。
さらに、以前の報告は、シクロオキシゲナーゼ-2(COX2)発現の増加が、化学療法抵抗性および子宮頚がんの予後不良と関連することを実証している。しかし、COX2が子宮頚がん細胞におけるジクロロ酢酸の感受性に影響を与えるかどうかは依然として不明である。
この研究では、子宮頚がん細胞がジクロロ酢酸に対して感受性が無いことがわかった。さらに、ジクロロ酢酸が子宮頚がん細胞のCOX-2の発現を亢進し、子宮頸がん細胞におけるジクロロ酢酸の化学感受性を妨げていることを初めて明らかにした。
メカニズムに関する研究は、ジクロロ酢酸がRNA
binding protein quaking(QKI)のレベルを低下させ、COX2 mRNAの分解を抑制してCOX2タンパク質の増加を引き起こすことを示した。
COX2阻害剤のセレコキシブの併用は、インビトロおよびインビボの両方の実験系でジクロロ酢酸に対する子宮頚がん細胞の感受性を高め、子宮頸がん細胞の増殖を抑制した。
これらの結果は、COX2がジクロロ酢酸の新規な抵抗因子であり、セレコキシブとジクロロ酢酸との組み合わせが子宮頚がんの治療に有益であり得ることを示している。
【解説】
RNA binding protein quaking(QKI)はRNA結合タンパク質であり、mRNA前駆体のスプライシング、mRNAの輸送、安定性、翻訳、miRNAのプロセシング、環状RNAの形成などに関与しています。
ジクロロ酢酸は子宮頚がん細胞にアポトーシスを誘導できますが、ジクロロ酢酸はCOX2の発現を増加し、COX-2は子宮頚がん細胞のジクロロ酢酸に対する感受性を低下させます。ジクロロ酢酸はCOX2のmRNAの安定性を亢進して、COX2たんぱく質を増やすからです。
そのため、COX2阻害剤のcelecoxibは、ジクロロ酢酸の抗腫瘍効果を高めることができるのです。
つまり、子宮頚がんを含めて、抗がん剤に対するがん細胞の感受性を高める目的でジクロロ酢酸を併用するときにはシクロオキシゲナーゼ-2(COX-2)阻害剤のcelecoxib(商品名:セレコックス)を併用するのが良いと言えます。
原文:
Oncotarget. 2017 Jun 16;8(31):51748-51757. doi:
10.18632/oncotarget.18518. eCollection 2017 Aug 1.
Inhibition of COX2 enhances the chemosensitivity of dichloroacetate in cervical cancer cells.
Abstract
Dichloroacetate (DCA), a traditional mitochondria-targeting agent, has shown promising prospect as a sensitizer in fighting against malignancies including cervical cancer. But it is unclear about the effect of DCA alone on cervical tumor. Moreover, previous reports have demonstrated that the increased cyclooxygenase-2 (COX2) expression is associated with chemoresistance and poor prognosis of cervical cancer. However, it is still unknown whether COX2 can affect the sensitivity of DCA in cervical cancer cells. In this study, we found that cervical cancer cells were insensitive to DCA. Furthermore, we for the first time revealed that DCA could upregulate COX2 which impeded the chemosensitivity of DCA in cervical cancer cells. Mechanistic study showed that DCA reduced the level of RNA binding protein quaking (QKI), leading to the decay suppression of COX2 mRNA and the subsequent elevation of COX2 protein. Inhibition of COX2 using celecoxib could sensitize DCA in repressing the growth of cervical cancer cells both in vitro and in vivo. These results indicate that COX2 is a novel resistance factor of DCA, and combination of celecoxib with DCA may be beneficial to the treatment of cervical cancer.
カンナビジオールはドキソルビシン誘発性心筋障害を防ぐ
カンナビジオールはドキソルビシン誘発性心筋障害を防ぐ
Cannabidiol Protects against Doxorubicin-Induced Cardiomyopathy by Modulating Mitochondrial Function and Biogenesis(カンナビジオールはミトコンドリアの機能と新生を制御することによってドキソルビシン誘発性心筋障害を防ぐ)Mol Med. 2015; 21(1): 38-45.
【要旨】
ドキソルビシンは広く使用されている抗腫瘍活性の高い抗がん剤であるが、その用量依存的な心臓毒性によって臨床使用に限界がある。
ドキソルビシンの心臓毒性には活性酸素や一酸化窒素による酸化ストレスの亢進や、心筋細胞や血管内皮細胞のミトコンドリア機能の障害や細胞死が関与している。
カンナビジオールは大麻に含まれる精神活性を持たない成分であり、有害作用は少なく、抗酸化作用や抗炎症作用を有し、さらに最近は抗腫瘍活性も報告されている。ドキソルビシン誘発性の心筋障害のマウスの実験モデルを用いて、カンナビジオールの効果を検討した。
ドキソルビシン誘発性心筋障害は心筋細胞のダメージのレベル(血清中のクレアチニンキナーゼと乳酸脱水素酵素の値)、活性酸素や一酸化窒素による細胞傷害のレベル(細胞内のグルタチオン量、グルタチオンペルオキシダーゼ1活性、脂質過酸化、3-ニトロチロシン形成、誘導性一酸化窒素合成酵素mRNAレベル)、心筋細胞死(アポトーシス、ポリADPリボースポリメラーゼ1依存性)、心筋機能(心拍出機能と左室内径短縮率)で評価した。
ドキソルビシンはミトコンドリア新生を抑制し、ミトコンドリア機能を低下させ(呼吸酵素複合体IとIIの活性低下)、心筋細胞における脱共役たんぱく2と3(uncoupling
protein 2 and 3)とmedium-chain acyl-CoA dehydrogenase mRNAの発現を低下させた。
カンナビジオールの投与は、これらのドキソルビシン誘発性の心筋機能の障害を改善し、活性酸素や一酸化窒素による細胞ストレスと細胞死を軽減した。
カンナビジオールは障害されたミトコンドリア機能とミトコンドリア新生を改善した。
これらの実験結果は、ドキソルビシンによる心筋障害に対する新たな治療法をしてカンナビジオールの有用性を示唆しており、ミトコンドリアの機能や新生に対するカンナビジオールの作用は、他の多くの組織障害の実験モデルでのカンナビジオールの作用機序を説明できるかもしれない。
解説:
カンナビジオールは、活性酸素や一酸化窒素による傷害を軽減する作用、ミトコンドリアの機能や新生を亢進する作用、炎症や細胞死を軽減する作用などのメカニズムで、ドキソルビシン誘発性の心筋傷害や心不全を予防する効果が期待できるという報告です。
この論文では、マウスの実験でカンナビジオールは1日1回、10mg/kgを腹腔内投与しています。人間に換算すれば1〜2mg/kg程度ですが、口腔内からの吸収率を20%くらいに考えると、ヒトでの口腔内(舌下投与)の1日量は5〜10mg/kg程度が基準になると思います。
(動物の標準代謝量は体重の3/4乗(正確には0.751乗)に比例するという法則があり、一般にマウスの体重当たりのエネルギー消費量や薬物の代謝速度は人間の約7倍と言われています。)
他の論文で、カンナビジオールはシスプラチンによる腎臓障害を軽減することが報告されています。さらに、多くのがん細胞に対して抗腫瘍活性を発揮することが報告されています。
カンナビジオールの安全性は極めて高いので、抗がん剤治療の副作用軽減と抗腫瘍効果増強にカンナビジオールの併用は有効だと言えます。
カンナビジオールの詳細は以下のサイトをご参照下さい。
http://www.f-gtc.or.jp/cannabidiol/CBDoil.html
【原文】
Mol Med. 2015 Jan 6;21:38-45. doi:
10.2119/molmed.2014.00261.
Cannabidiol
Protects against Doxorubicin-Induced Cardiomyopathy by Modulating Mitochondrial
Function and Biogenesis.
Hao E1,2, Mukhopadhyay P1, Cao Z1, Erdélyi K1, Holovac E1, Liaudet L3, Lee WS1,4, Haskó G5, Mechoulam R6, Pacher P1.
Abstract
Doxorubicin (DOX) is a widely used, potent chemotherapeutic agent; however, its clinical application is limited because of its dose-dependent cardiotoxicity. DOX's cardiotoxicity involves increased oxidative/nitrative stress, impaired mitochondrial function in cardiomyocytes/endothelial cells and cell death. Cannabidiol (CBD) is a nonpsychotropic constituent of marijuana, which is well tolerated in humans, with antioxidant, antiinflammatory and recently discovered antitumor properties. We aimed to explore the effects of CBD in a well-established mouse model of DOX-induced cardiomyopathy. DOX-induced cardiomyopathy was characterized by increased myocardial injury (elevated serum creatine kinase and lactate dehydrogenase levels), myocardial oxidative and nitrative stress (decreased total glutathione content and glutathione peroxidase 1 activity, increased lipid peroxidation, 3-nitrotyrosine formation and expression of inducible nitric oxide synthase mRNA), myocardial cell death (apoptotic and poly[ADP]-ribose polymerase 1 [PARP]-dependent) and cardiac dysfunction (decline in ejection fraction and left ventricular fractional shortening). DOX also impaired myocardial mitochondrial biogenesis (decreased mitochondrial copy number, mRNA expression of peroxisome proliferator-activated receptor γ coactivator 1-alpha, peroxisome proliferator-activated receptor alpha, estrogen-related receptor alpha), reduced mitochondrial function (attenuated complex I and II activities) and decreased myocardial expression of uncoupling protein 2 and 3 and medium-chain acyl-CoA dehydrogenase mRNA. Treatment with CBD markedly improved DOX-induced cardiac dysfunction, oxidative/nitrative stress and cell death. CBD also enhanced the DOX-induced impaired cardiac mitochondrial function and biogenesis. These data suggest that CBD may represent a novel cardioprotective strategy against DOX-induced cardiotoxicity, and the above-described effects on mitochondrial function and biogenesis may contribute to its beneficial properties described in numerous other models of tissue injury.
ビタミンD3+メトホルミン+ケトン食が乳がんに効く可能性がある
ビタミンD3+メトホルミン+ケトン食が乳がんに効く可能性がある
Effects of Pre-surgical Vitamin D Supplementation and Ketogenic Diet in a Patient with Recurrent Breast Cancer.(再発乳がん患者における術前のビタミンD補充とケトン食の効果)Anticancer Res. 2015 Oct;35(10):5525-32.
【要旨】
研究の背景:19歳で出産した1児の母親である女性が、1985年(37歳)に右の乳がんと診断された。患者は腫瘍の摘出(乳房温存手術)とリンパ節廓清、放射線治療を受けた。
1999年に左乳房に乳がんが見つかり、切除と放射線治療が行われ、さらにホルモン療法(タモキシフェン)を6年間受けた。
2014年の3月に、1985年に手術と放射線治療を受けた乳腺の残存乳腺組織から浸潤性乳管がんが発見された。
症例報告:術前の生検による病理検査では、プロゲステロン受容体(PgR)の発現は少なく(<1%)、エストロゲン受容体(ER)は強陽性(90%)で、ヒト上皮増殖因子受容体(HER2)は陽性(>10%, score 2+)、増殖活性を示す核タンパク質Ki67は強陽性(30%)であった。
診断から手術まで3週間あり、その間の治療の計画が無かったので、患者は自分の判断で、ビタミンD3(1日10,000 IU)と厳格なケトン食を実施した。
結果:右乳房切除を行われた。切除組織の病理検査でHER2の発現は全く認めず(陰性、score 0)で、PgRの発現は亢進していた(20%)。ERとKi67の陽性度は変化なかった。
結論:この症例は、高用量のビタミンD3とケトン食の併用は、乳がん細胞のHER2発現を抑制し、プロゲステロン受容体の発現を亢進するなど、乳がん細胞の生物学的性状に影響を及ぼす可能性を示唆している。
これは1例の症例報告ですので、高用量のビタミンD3とケトン食の併用が乳がんに有効かどうかのエビデンスは低いのですが、高用量のビタミンD3とケトン食はそれぞれ乳がんに対する効果が報告されているので、この2つの治療の併用を試してみる価値はあるかもしれません。
また、ビタミンD3とメトホルミンの相乗効果は乳がんや前立腺がんや大腸がんなどで報告されています。メトホルミンはAMP活性化プロテインキナーゼ(AMPK)を活性化してAkt/mTORシグナル伝達系を阻害し、がん細胞の増殖を抑制します。ビタミンD3はメトホルミンの抗腫瘍効果を高めます。次のような報告があります。
Synergistic antitumor activity of vitamin D3 combined with metformin in human breast carcinoma MDA-MB-231 cells involves m-TOR related signaling pathways. (ヒト乳がん細胞MDA-MB-231細胞におけるビタミンD3とメトホルミンの併用による相乗的な抗腫瘍効果はmTOR関連のシグナル伝達系が関与する)Pharmazie. 2015 Feb;70(2):117-22.
メトホルミンは2型糖尿病の治療に使用されていますが、最近の多くの研究によって、メトホルミンとビタミンDは多くのがん細胞に対して抗腫瘍効果を示すことが示されています。
この研究では、ヒト乳がん細胞株MDA-MB-231を用いて、ビタミンD3とメトホルミンの併用はアポトーシス誘導において相乗効果があることを報告しています。その抗腫瘍効果の発現にはmTOR関連のシグナル伝達系が関与することを報告しています。つまり、ビタミンD3とメトホルミンはmTOR(哺乳類ラパマイシン標的蛋白質)の活性を阻害することによってアポトーシスを誘導することを示しています。
前立腺がんや大腸がんでも同様の効果が報告されています。
Vitamin D3 potentiates the growth inhibitory
effects of metformin in DU145 human prostate cancer cells mediated by AMPK/mTOR
signalling pathway. (ヒト前立腺がん細胞DU145におけるAMPK/mTORシグナル伝達系を介するメトホルミンの増殖阻害作用をビタミンD3は増強する)Clin Exp Pharmacol Physiol. 2015
Jun;42(6):711-7.
前述のようにメトホルミンはAMPKを活性化してAkt/mTORシグナル伝達系を抑制し、抗腫瘍効果を発揮します。ビタミンD3はメトホルミンのAkt/mTORシグナル伝達系の抑制効果を増強して、アポトーシス誘導を亢進するという作用機序です。
Akt/mTORシグナル伝達系は、インスリンやインスリン様成長因子-1(IGF-1)などの増殖因子や成長因子で活性化され、タンパク質や脂質の合成や、細胞分裂や細胞死や血管新生やエネルギー産生などに作用してがん細胞の増殖を促進します。
メトホルミンはAMP依存性プロテインキナーゼ(AMPK)を活性化し、活性化してAMPKはmTORを抑制することによって、がん細胞の増殖を抑制します。
Combined use of vitamin D3 and metformin
exhibits synergistic chemopreventive effects on colorectal neoplasia in rats
and mice. (ビタミンD3とメトホルミンの併用はラットとマウスの結腸直腸がんの発生に対して相乗的な化学予防効果を示す)Cancer Prev Res (Phila). 2015 Feb;8(2):139-48.
この研究はラットとマウスを用いた大腸発がん実験での検討です。メトホルミンは化学発がんモデルで大腸がんの発生を抑制する作用があります。ビタミンD3はメトホルミンの発がん抑制作用を増強するという結果です。そのメカニズムとして、mTOR活性の抑制を認めています。さらに、ビタミンD3にはビタミンD受容体/β-カテニンのシグナル伝達系に作用してβ-カテニンの働きを抑制することによってc-MycやサイクリンD1の発現を抑制する作用も指摘しています。
ビタミンD3とメトホルミンの併用は、相乗効果によって発がん抑制や抗腫瘍効果を高めることができるという結論です。
ケトン食もAMPKを活性化し、Akt/mTORシグナル伝達系を抑制します。したがって、ケトン食を実践しているとき、ビタミンD3とメトホルミンを併用すると、抗腫瘍効果を高めることができます。
進行した乳がんの代替医療として、高用量(1日4000〜10000国際単位)のビタミンD3とメトホルミン(1日1000〜1500mg程度)とケトン食の組合せは、相乗効果が期待できると考えられます。ビタミンD3もメトホルミンも安価ですので、試してみる価値は高いと言えます。
この組合せは乳がんだけでなく、大腸がんや膵臓がんや肺がんなど他のがんにも効果が期待できます。
カンナビジオールはパクリタキセルの神経障害を軽減する
カンナビジオールはパクリタキセルの神経障害を軽減する
Cannabidiol
inhibits paclitaxel-induced neuropathic pain through 5-HT(1A)
receptors without diminishing nervous system function or chemotherapy efficacy.
(カンナビジオールは、神経系の機能や抗がん剤の効果を減弱することなく、5HT1A受容体を介してパクリタキセル誘発性の神経障害性疼痛を阻止する)Br J
Pharmacol. 171(3):636-45.2014年
【要旨】
研究の背景と目的:パクリタキセルは末梢神経にダメージを与えて痛みを引き起こす副作用があり、これによって抗がん剤治療を中断せざるを得ない場合もある。我々は以前の研究において、精神変容作用を持たないカンアビノイド(大麻に含まれるある種の成分の総称)の一つであるカンナビジオールが、パクリタキセルによる機械的および温熱による疼痛感受性の亢進を阻止する作用を有することをマウスを使った実験で明らかにした。
抗がん剤による末梢神経障害を阻害するカンナビジオールの作用のメカニズムを明らかにし、カンナビジオールの作用が神経機能や抗がん剤の抗腫瘍効果を減弱させる作用がないかどうかを検討した。
主な結果:マウス(C57Bl/6 mice)を使った実験で、パクリタキセルで誘発される機械的刺激に対する疼痛感受性の亢進はカンナビジオール(2.5~10mg/体重1kg)の投与によって阻止された。この効果は5−HT(1A)受容体のアンタゴニスト(拮抗薬、阻害薬)であるWAY100635の同時投与によって減弱したが、カンナビノイド受容体のCB1のアンタゴニスト(SR141716)やCB2のアンタゴニスト(SR144528)では減弱しなかった。カンナビジオールの投与によってマウスの学習機能や認知機能などに低下は認めなかった。
培養乳がん細胞を用いた実験では、パクリタキセルとカンナビジオールの併用は、相加あるいは相乗的な抗腫瘍効果の増強を示した。
結論:今回の実験結果より、カンナビジオールはパクリタキセルによって引き起こされる神経障害を予防する効果を示し、その作用機序として5-HT1A受容体を介する機序が示唆された。さらに、学習効果や認知機能などの神経系の働きに悪影響は及ぼさず、乳がん細胞に対するパクリタキセルの抗腫瘍効果を減弱させることはなかった。以上のことから、パクリタキセルによる抗がん剤治療にカンナビジオールを併用することは、神経障害の発生予防や軽減において有効で安全な治療法と言える。
http://www.f-gtc.or.jp/cannabidiol/CBDoil.html
Br J Pharmacol. 2014
Feb;171(3):636-45. doi: 10.1111/bph.12439.
Cannabidiol inhibits
paclitaxel-induced neuropathic pain through 5-HT(1A) receptors without
diminishing nervous system function or chemotherapy efficacy.
Abstract
BACKGROUND AND PURPOSE:
Paclitaxel (PAC) is
associated with chemotherapy-induced neuropathic pain (CIPN) that can lead to
the cessation of treatment in cancer patients even in the absence of alternate
therapies. We previously reported that chronic administration of the
non-psychoactive cannabinoid cannabidiol (CBD) prevents PAC-induced mechanical
and thermal sensitivity in mice. Hence, we sought to determine receptor
mechanisms by which CBD inhibits CIPN and whether CBD negatively effects
nervous system function or chemotherapy efficacy.
EXPERIMENTAL APPROACH:
The ability of acute CBD
pretreatment to prevent PAC-induced mechanical sensitivity was assessed, as was
the effect of CBD on place conditioning and on an operant-conditioned learning
and memory task. The potential interaction of CBD and PAC on breast cancer cell
viability was determined using the MTT assay.
KEY RESULTS:
PAC-induced mechanical
sensitivity was prevented by administration of CBD (2.5 - 10 mg·kg⁻¹) in
female C57Bl/6 mice. This effect was reversed by co-administration of the
5-HT(1A) antagonist WAY 100635, but not the CB₁
antagonist SR141716 or the CB₂
antagonist SR144528. CBD produced no conditioned rewarding effects and did not
affect conditioned learning and memory. Also, CBD + PAC combinations produce
additive to synergistic inhibition of breast cancer cell viability.
CONCLUSIONS AND IMPLICATIONS:
Our data suggest that CBD is
protective against PAC-induced neurotoxicity mediated in part by the 5-HT(1A)
receptor system. Furthermore, CBD treatment was devoid of conditioned rewarding
effects or cognitive impairment and did not attenuate PAC-induced inhibition of
breast cancer cell viability. Hence, adjunct treatment with CBD during PAC chemotherapy
may be safe and effective in the prevention or attenuation of CIPN.
水素水は放射線治療のQOL(生活の質)を良くする
水素水は放射線治療のQOL(生活の質)を良くする
Effects of drinking hydrogen-rich water on the quality of life of patients treated with radiotherapy for liver tumors. (肝臓腫瘍の放射線治療を受けた患者の生活の質に対する水素水の飲用の効果) Medical Gas Research 2011;1:11. doi:10.1186/2045-9912-1-11.
【要旨】 背景:放射線治療を受けているがん患者は倦怠感や生活の質(QOL)の低下をしばしば経験する。放射線治療の副作用の多くは、放射線照射中に発生する活性酸素種による酸化ストレスや炎症の亢進によるものと考えられている。 水素は治療目的での医療用ガスとしても利用されており、抗酸化作用をもち、組織における炎症を軽減する効果がある。 この研究では、水素を含有させた水(hydrogen-supplemented water)を飲用するという水素治療が放射線治療を受けている患者のQOL(生活の質)を改善できるかどうかを検討した。 方法:肝臓の悪性腫瘍に対して放射線治療を受けている49人を対象に、水素を含有させた水(hydrogen-rich water)を飲用する効果を検討するために、無作為プラセボ比較臨床試験を行った。 水素水は飲用水の中に金属マグネシウムの棒(metallic magnesium stick)を入れて作成した。最終的には水素濃度は0.55~0.65 mMであった。 患者の健康状態やQOL(生活の質)は欧州がん研究・治療機構(European Organization for Research and Treatment of Cancer:EORTC)が開発したEORTC-QLQ-C30の韓国版を用いて行った。 末梢血における活性酸素種の代謝産物の濃度や生物学的抗酸化能(biological antioxidant power)を測定した。 結果:水素水の6週間の飲用は血中における活性酸素代謝産物の量を減らし、血液の抗酸化能を維持した。水素の含有しない水(プラセボ)を飲用した群(対照群)に比べて、水素水を飲用した群では放射線治療中のQOLスコアが顕著に良好であった。 プラセボ群と水素水飲用群との間には、放射線治療の奏功率に違いは認めなかった。 結論:水素水の日常的な飲用は、放射線照射後のQOL(生活の質)を改善する方法として新規で治療効果の高い治療法であることが示された。
水素水の飲用は、放射線治療の抗腫瘍効果を弱めることなく、放射線照射によって引き起こされる酸化ストレスに対する生体応答を減弱させることができる。
(注)
放射線治療を受けると、倦怠感、吐気、食欲低下、うつ症状などの症状が急性期の副作用として現れます。照射した部分の皮膚には皮膚組織のダメージが起こります。また、時間がたってから現れる後遺症として、がんの発生、中枢神経系や循環器の疾患、白内障などがあります。
このような副作用や後遺症は照射した部位や量や照射法や治療を受けた人の放射線感受性の違いなどに左右されます。
これらは、放射線照射によって発生する活性酸素種による酸化ストレスや炎症反応によって生じると考えられており、生活の質(QOL)を低下させる要因になっています。
水素はヒドロキシラジカルを選択的に消去します。
水素水の飲用や水素ガスの吸入が動脈硬化、2型糖尿病、メタボリック症候群、老化やパーキンソン病などに伴う認知機能の低下などに対して有効な治療効果を示すことが報告されています。
この論文では、人間でのランダム化プラセボ対照比較臨床試験で、水素水の飲用が放射線治療中の患者の抗酸化能を高め、QOL(生活の質)の改善に効果があるという結果を報告しています。
この研究では、水素が0.55~0.65 mMの含有量の水素水を1日2000cc飲用しています。
プラセボとの比較では、倦怠感、抑うつ症状、睡眠、吐気、下痢には差を認めていませんが、食欲低下や味覚障害の改善効果は水素水の飲用で統計的に有意な改善を認めています。
副作用を軽減しても、抗腫瘍効果を妨げると意味がありません。そもそも放射線照射は細胞内や組織の水分子に放射線があたって発生するヒドロキシラジカルの細胞傷害作用でがん細胞を死滅させます。
したがって、ヒドロキシラジカルを消去する水素が抗腫瘍効果を妨げる可能性があります。この点については、水素水飲用群と対照群で放射線治療の奏功率で比較しています。
腫瘍の縮小の率(完全奏功と部分奏功)は水素水飲用群が50.0%、プラセボ群が48%で治療効果に違いは無いという結果でした。
また、水素水飲用による肝機能やその他の血液検査の異常は認められていません。
以上の結果から、放射線治療中に水素水を多く摂取することは、放射線治療の副作用を軽減し、放射線治療に伴うQOLの低下を予防する方法として有効であるという結論です。
メトロノミック・ケモテラピーで長期間生存した乳がん肝臓転移の症例報告。
メトロノミック・ケモテラピーで長期間生存した乳がん肝臓転移の症例報告。
Long-term complete response in a patient with liver metastases from breast cancer treated with metronomic chemotherapy.(メトロノミック・ケモテラピーで治療した乳がんの肝臓転移の患者における長期間の完全奏功)Tumori. 100(3):79e-82e.2014年 doi: 10.1700/1578.17238.
【要旨】
背景:幾つかの抗がん剤は低用量で使用すると血管系に作用する可能性が多くの研究で指摘されている。このレポートでは、メトロノミック・ケモテラピーによって長期間に渡ってがんの増殖を抑制できた症例を報告する。
症例提示:患者は62歳の女性で左側の乳がんに対して乳房切除が2007年7月に行われた。肝臓転移に対してファーストラインの抗がん剤治療としてドキソルビシンとパクリタキセルによる21日間サイクルの投与が行われた。6サイクルの治療後のCT検査では部分奏功を認めた。ドキソルビシンとパクリタキセルによる抗がん剤治療を中止し、シクロホスファミド(50mg/日経口)とメソトレキセート(2.5mg x 2回/日、週2日)によるメトロノミック・ケモテラピーに変更した。この維持療法を開始してから6ヶ月後のCT検査で完全奏功を認めた。
患者の原発部位の病理検査で血管内皮増殖因子受容体2(VEGFR2)の過剰発現を認めた。
メトロノミック・ケモテラピーはまだ継続中であるが、60ヶ月経過して現在も完全奏功の状態を維持している。
結論:この症例はメトロノミック・ケモテラピーが維持療法として有効であり、特に毒性(副作用)を認めずに長期間の治療が可能であることを示している。腫瘍におけるVEGFR2の発現量が多い場合は、メトロノミック・ケモテラピーによる血管新生阻害作用が奏功する可能性を示唆する。
(注)
完全奏功(complete
response)というのは、がん組織が目に見えないレベルに縮小(消滅)することです。顕微鏡レベルで残っている可能性はありますが、がん組織が消滅した状態が続けば延命できます。
メトロノミック・ケモテラピーで著効を示した症例報告や、メトロノミック・ケモテラピーの有効性や通常の抗がん剤治療より有効であることを示す臨床試験の結果も得られています。
最大耐用量を投与する通常の抗がん剤治療は白血病やリンパ腫や精巣腫瘍のような一部のがんには有効ですが、肺がんや膵臓がんや乳がんなど多くの固形がんにはあまり効果がなく、副作用のデメリットの方が高いことが指摘されています。
最大耐用量を投与すると一時的にはがんが縮小しても、正常組織における修復反応と同様に、がん組織も傷を受けると炎症細胞の浸潤や血管新生が誘導されて、結果的にがん細胞の増殖が促進するからです。
標準治療の抗がん剤治療は一時的な縮小を目標にするため、長期の延命はむしろ犠牲にしている可能性があります。通常の抗がん剤治療は何もしないよりかは延命していますが、メトロノミック・ケモテラピーや副作用の少ない治療を組み合わせた治療よりも勝っているとはいえないという意見が増えています。
この論文で使用されているシクロホスファミド(50mg/日経口)とメソトレキセート(2.5mg x 2回/日、週2日)を薬価ベースで計算すると1ヶ月分で約2000円です。この低用量のシクロホスファミド(商品名エンドキサン)とメソトレキセートと使ったメトロノミック・ケモテラピーをベースにして、さらに血管新生阻害、エネルギー産生阻害(グルコース取り込みや解糖系の阻害)、脂肪酸合成やメバロン酸経路の阻害、微小管重合阻害、抗炎症作用などの作用を持った薬などを併用すると、がんを縮小させることができます。
○メトロノミック・ケモテラピーについては以下のサイトを解説しています。
http://www.f-gtc.or.jp/metronomic/metronomic-chemotherapy.html
Tumori. 2014 May-Jun;100(3):e79-82. doi:
10.1700/1578.17238.
Long-term complete response in a patient
with liver metastases from breast cancer treated with metronomic chemotherapy.
Cecconetto L, Casadei Gardini A, Tenti E, Maltoni R, Bravaccini S, Oboldi D, Zoli W, Serra P, Donati C, Sarti S, Amadori D, Rocca A.
Abstract
BACKGROUND:
Preclinical studies have shown that
several chemotherapeutic agents at low doses may affect the vascular system.
Here we report the case of a patient with long-term cancer control by
metronomic chemotherapy.
CASE PRESENTATION:
A 62-year-old woman with breast cancer
underwent a left mastectomy in July 2007. For a liver metastasis she was given
first-line chemotherapy with doxorubicin plus paclitaxel every 21 days. A CT
scan after the sixth cycle showed a partial response. It was decided to stop
the treatment with doxorubicin and paclitaxel, and start metronomic therapy
with cyclophosphamide 50 mg daily orally and methotrexate 2.5 mg twice daily, 2
days a week. After 6 months of this maintenance treatment, CT scan showed a
complete response. We examined the expression of vascular endothelial growth
factor receptor 2 (VEGFR2) in histological sections of the primary tumor of our
patient, finding evidence of overexpression of the receptor. The metronomic
treatment is still ongoing, and after 60 months the patient maintains a
complete response.
CONCLUSION:
This clinical case highlights how suitable metronomic
chemotherapy can be used as maintenance therapy, allowing long-term treatment
with no significant toxicity. This case suggests that the level of VEGFR2 is
predictive of best response to antiangiogenic therapy.
メトホルミンは直腸がんの化学放射線療法の効き目を高める
メトホルミンは直腸がんの化学放射線療法の効き目を高める
Metformin use and improved response to therapy in
rectal cancer(メトホルミンは直腸がんの治療効果を高める)Cancer Med.
2(1): 99-107, 2013年
【要旨】
原発部位が進行している直腸がんの場合は、手術前に化学放射線治療(chemoradiation)を行って腫瘍を縮小させてから全直腸間膜切除術(TME;total mesorectal excision)を行うことが多い。
メトホルミンが直腸がんの化学予防剤として有効である可能性や、直腸がんの治療効果を高める可能性が今までの多くの研究によって示唆されている。
そこで、この研究では、直腸がんの化学放射線治療の病理学的完全奏功率(pathologic complete response rates)と予後に対するメトホルミンの効果を検討した。
局所進行した直腸腺がんで1996年から2009年の間に化学放射線療法と全直腸間膜切除術を受けた482例のカルテを検証した。
放射線照射量の中央値は50.4Gy(19.8〜63 Gy)で、98%の患者は5-FUをベースにした抗がん剤の同時投与を受け、81.3%は放射線治療後に抗がん剤治療を受けた。
422例は非糖尿病患者で、40例は糖尿病がありメトホルミンを服用していない患者で、20例は糖尿病があってメトホルミンを服用していた。
この3つのグループの間には、がんの臨床的分類や、リンパ節転移の状況、肛門からの腫瘍の距離、がんの深達度、診断時の腫瘍マーカー(CEA)の値、がん細胞の分化度において差を認めなかった。
病理学的完全奏功(pathologic complete response)の率は、非糖尿病患者が16.6%、メトホルミンの投与を受けていない糖尿病患者が7.5%、メトホルミンを服用している糖尿病患者が35%であった。
メトホルミンを服用している糖尿病の患者のグループは、非糖尿病のグループ(p=0.03)と糖尿病でメトホルミンを服用していないグループ(p=0.007)と比べて、統計的有意に化学放射線治療の病理学的完全奏功率が高かった。
メトホルミンの併用は、単変量解析(p=0.05)と多変量解析(p=0.01)の療法の解析で、病理学的完全奏功率と統計的有意に相関していた。
さらに、メトホルミンを服用している糖尿病患者では、メトホルミンを服用していない糖尿病患者に比べて、無再発生存期間(p=0.013)と全生存期間(p=0.008)が統計的有意に長かった。
メトホルミンの服用は、直腸がんの術前化学放射線治療の病理学的完全奏功率を高め、生存期間を延長する効果が認められた。さらに前向き研究によって、このメトホルミンの効果を検証する必要がある。
(訳者注)
この論文は、米国のテキサス大学MDアンダーソンがん研究所からの研究報告です。
局所進行した直腸がんの場合、手術で切除する前に放射線治療と5-FUベースの抗がん剤治療の併用によって腫瘍を縮小させてから摘出手術を行うことが欧米では標準治療となっており、手術単独の場合にくらべて優れた治療成績が報告されています。日本でも術前の化学放射線療法を併用する所が増えています。
手術前に化学放射線治療を行って、手術で切除したがん組織を病理で検査すると、生きたがん細胞が見つからない(がんが完全に死滅している)場合があり、これを病理学的完全奏功(pathological complete response)といいます。
病理学的完全奏功が認められた患者さんは、再発率が低く、予後が極めて良いとこが明らかになっています。したがって、手術前の化学放射線療法(放射線治療と抗がん剤治療)の効果を高めるための抗がん剤の組み合わせの検討や、化学放射線療法の効き目を高める補助療法の検討が行われています。
この臨床試験は、過去に遡った後ろ向きの研究ですが、メトホルミンが直腸がんの化学放射線療法の効果を高めることが示されています。
通常、糖尿病があると、直腸がんや大腸がんの手術後の再発率が高くなることが、過去の疫学研究で示されています。さらに、直腸がんの術前化学放射線療法の効果も低いことが知られています。ある臨床試験では、直腸がんの術前化学放射線療法で病理学的完全奏功率が非糖尿病患者で23%に対して糖尿病患者では0%という結果が報告されています(Ann. Surg. Oncol. 2008;15:1931-1936)。
しかし、メトホルミンを服用している糖尿病患者は、メトホルミンを服用していない糖尿病患者だけでなく、糖尿病がない(したがってメトホルミンも服用していない)患者よりも、病理学的完全奏功の率が高かったという結果が得られており、メトホルミン自体に化学放射線療法の効果を高める作用を示唆しています。
直腸がんの術前化学放射線治療における病理学的完全奏功率は、今までの臨床試験では15%前後の数値が報告されています。この論文のデータでも非糖尿病のグループの病理学的完全奏功率は16.6%です。それに比べてメトホルミンを服用しているグループでは35%に増えています。
メトホルミンはミトコンドリアの呼吸酵素を阻害してATP産生を阻害し、AMP依存性プロテインキナーゼを活性化する作用があり、その他にも複数の抗腫瘍効果が報告されています。
がん細胞のエネルギー産生を抑制することは抗がん剤や放射線の治療効果を高める方法として有効であることは十分に理解できると思います。
メトホルミンは糖尿病の治療薬ですが、インスリン感受性を高めてインスリンの分泌を減らす作用(少ないインスリン量で血糖をコントロールできるようにする作用)であるため、糖尿病がなくても服用できます。
最近は糖尿病が無いがん患者にメトホルミンを投与して抗がん剤の効き目を高めるを作用を認めたという報告もあります。
抗がん剤や放射線治療の補助療法としてメトホルミンの併用は有用と言えそうです。
◎ メトホルミンの抗がん作用については以下のサイトで解説しています。
http://www.1ginzaclinic.com/metfomin/metformin.html
(原文)
Cancer Med. 2013 Feb;2(1):99-107.
doi: 10.1002/cam4.54. Epub 2013 Feb 3.
Metformin use and improved response
to therapy in rectal cancer.
Skinner HD, Crane CH, Garrett CR, Eng C, Chang GJ, Skibber JM, Rodriguez-Bigas MA, Kelly P, Sandulache VC, Delclos ME, Krishnan S, Das P.
Author information
Abstract
Locally advanced rectal cancer is commonly treated with chemoradiation prior to total mesorectal excision (TME). Studies suggest that metformin may be an effective chemopreventive agent in this disease as well as a possible adjunct to current therapy. In this study, we examined the effect of metformin use on pathologic complete response (pCR) rates and outcomes in rectal cancer. The charts of 482 patients with locally advanced rectal adenocarcinoma treated from 1996 to 2009 with chemoradiation and TME were reviewed. Median radiation dose was 50.4 Gy (range 19.8-63). Nearly, all patients were treated with concurrent 5-fluorouracil-based chemotherapy (98%) followed by adjuvant chemotherapy (81.3%). Patients were categorized as nondiabetic (422), diabetic not taking metformin (40), or diabetic taking metformin (20). No significant differences between groups were found in clinical tumor classification, nodal classification, tumor distance from the anal verge or circumferential extent, pretreatment carcinoembryonic antigen level, or pathologic differentiation. pCR rates were 16.6% for nondiabetics, 7.5% for diabetics not using metformin, and 35% for diabetics taking metformin, with metformin users having significantly higher pCR rates than either nondiabetics (P = 0.03) or diabetics not using metformin (P = 0.007). Metformin use was significantly associated with pCR rate on univariate (P = 0.05) and multivariate (P = 0.01) analyses. Furthermore, patients taking metformin had significantly increased disease-free (P = 0.013) and overall survival (P = 0.008) compared with other diabetic patients. Metformin use is associated with significantly higher pCR rates as well as improved survival. These promising data warrant further prospective study.
フェノフィブラートはグリオブラストーマ細胞のアポトーシスを誘導する
フェノフィブラートはグリオブラストーマ細胞のアポトーシスを誘導する
Fenofibrate-induced nuclear translocation of FoxO3A triggers Bim-mediated apoptosis in glioblastoma cells in vitro.(培養したグリオブラストーマ細胞におけるフェノフィブレラートによって誘導されるFoxO3Aの核内移行はBimを介するアポトーシスを引き起こす)
Cell Cycle.
11(14):2660-71.2012年
米国のルイジアナ州立大学健康科学センター(Louisiana State University
Health Sciences Center)の神経腫瘍研究部門(Neurological Cancer Research)からの報告です。
【要旨】
カロリー制限あるいはペルオキシソーム増殖因子活性化受容体(Peroxisome Proliferator Activated Receptors:PPARs)のリガンド誘導性の活性化による抗腫瘍活性については多くの研究で示されている。しかしながら、その作用機序については十分に解明されていない。PPARα(ペルオキシソーム増殖因子活性化受容体α)の強力なアゴニスト(受容体分子に結合して本来の伝達物質やホルモンと同様の作用を示す物質)の一つであるフェノフィブラート(fenofibrate)は、副作用の少ない抗高脂血症薬として広く使用されている。
フェノフィブラートによって活性化されるPPARα転写活性は、エネルギー代謝をグルコースの解糖系から脂肪酸のβ酸化へとシフトさせることが予想され、これは解糖系に依存性の高いグリオブラストーマ細胞のエネルギー代謝の弱点をターゲットにすることができる。
本研究の結果は、グリオーマ(神経膠腫)細胞やグリオブラストーマ(神経膠芽腫)細胞の増殖を25μMのフェノフィブラートが効果的に抑制することを示している。この細胞増殖抑制作用は細胞周期のG1期での停止と少数のアポトーシスによる細胞死によって起こっていた。25μMのフェノフィブラートで処理されたがん細胞は増殖を停止したままであったが、50μMの濃度でがん細胞を処理すると、72時間後に大量の細胞がアポトーシスによって死滅した。このアポトーシスの発現に先立って、転写因子FoxP3Aのセリン413のリン酸化が起こってFoxO3Aは核に移行し、その転写活性が亢進してFoxO3Aのターゲット遺伝子であるBim の発現を亢進する。Bimの発現亢進は細胞のアポトーシスを引き起こす。この時、FoxO3Aの活性をsiRNAで阻害すると、フェノフィブラートで引き起こされるアポトーシスは阻止される。つまり、フェノフィブラートで誘導されるグリオブラストーマのアポトーシスはFoxO3Aの活性化が直接関与していることが示された。
フェノフィブラートのこのような抗腫瘍作用と、副作用の少ない薬であることから、グリオブラストーマなどの神経膠細胞の腫瘍に対する標準治療をサポートする薬の候補になるかもしれない。
【訳者注】
グリオブラストーマ(神経膠芽腫)はヒトの悪性腫瘍の中で最も予後不良の腫瘍の一つです。手術や放射線治療や抗がん剤治療などが行われますが、このような集学的治療をおこなっても平均生存期間は12~14カ月程度であり,治療成績はここ30年以上変化がないと言われています。
このグリオブラストーマに対してフィブラート系の高脂血症治療薬のフェノフィブラートが抗腫瘍効果を示すという実験結果を報告しています。
フェノフィブラートは本来のPPARαを介した機序と、それとは関係ない機序によって抗腫瘍効果を示しました。
Bimはがん細胞のミトコンドリアに作用してアポトーシスを誘導するタンパク質で、転写因子のFoxO3Aによって発現が誘導されます。フェノフィブラートはFoxO3Aを活性化してBimの発現を誘導してグリオブラストーマ細胞の増殖抑制とアポトーシス誘導を引き起こすことが報告されています。
【原文】
Cell Cycle. 2012 Jul 15;11(14):2660-71. doi: 10.4161/cc.21015. Epub
2012 Jul 15.
Fenofibrate-induced nuclear translocation of FoxO3A
triggers Bim-mediated apoptosis in glioblastoma cells in vitro.
Wilk A, Urbanska K, Grabacka M, Mullinax J, Marcinkiewicz C, Impastato D, Estrada JJ, Reiss K.
Source
Neurological Cancer Research, Louisiana State University
Health Sciences Center, New Orleans, LA, USA.
Abstract
Anti-neoplastic potential of calorie restriction or ligand-induced activation of peroxisome proliferator activated receptors (PPARs) has been demonstrated in multiple studies; however, mechanism(s) by which tumor cells respond to these stimuli remain to be elucidated. One of the potent agonists of PPARα, fenofibrate, is a commonly used lipid-lowering drug with low systemic toxicity. Fenofibrate-induced PPARα transcriptional activity is expected to shift energy metabolism from glycolysis to fatty acid β-oxidation, which in the long-term, could target weak metabolic points of glycolysis-dependent glioblastoma cells. The results of this study demonstrate that 25 μM fenofibrate can effectively repress malignant growth of primary glial tumor cells and glioblastoma cell lines. This cytostatic action involves G(1) arrest accompanied by only a marginal level of apoptotic cell death. Although the cells treated with 25 μM fenofibrate remain arrested, the cells treated with 50 μM fenofibrate undergo massive apoptosis, which starts after 72 h of the treatment. This delayed apoptotic event was preceded by FoxO3A nuclear accumulation, FoxO3A phosphorylation on serine residue 413, its elevated transcriptional activity and expression of FoxO-dependent apoptotic protein, Bim. siRNA-mediated inhibition of FoxO3A attenuated fenofibrate-induced apoptosis, indicating a direct involvement of this transcription factor in the fenofibrate action against glioblastoma. These properties of fenofibrate, coupled with its low systemic toxicity, make it a good candidate in support of conventional therapies against glial tumors.
オメガ3不飽和脂肪酸はパクリタキセルの末梢神経障害を軽減する
オメガ3不飽和脂肪酸はパクリタキセルの末梢神経障害を軽減する
Omega-3 fatty acids are protective against paclitaxel-induced peripheral
neuropathy: a randomized double-blind placebo controlled trial.(オメガ-3脂肪酸はパクリタキセルによる末梢神経障害を軽減する:ランダム化二重盲検プラセボ対照試験)BMC Cancer 2012 Aug 15:12:355
【要旨】
背景:知覚性末梢神経の軸索障害(axonal sensory peripheral neuropathy)はパクリタキセルの主な用量制限性の副作用である。オメガ3系不飽和脂肪酸は神経細胞に対する保護作用と、末梢神経障害の発生に関与している炎症性サイトカインの産生を阻害する作用によって、様々な神経系疾患に対して治療効果を有している。
方法:パクリタキセルによって引き起こされる末梢神経障害に対して、オメガ3系不飽和脂肪酸に末梢神経障害の発生頻度や重症度を減らす効果があるかどうかを検討する目的で、ランダム化二重盲検プラセボ対照試験を行った。
本研究の目的に合致した乳がん患者を無作為に2群に分け、パクリタキセルによる治療中および治療終了後1ヶ月間の間、1群にはオメガ3系不飽和脂肪酸(1回640mg,1日3回)を摂取させ、もう1群(コントロール群)にはプラセボを摂取させた。
抗がん剤開始前と終了後1ヶ月経過後に、患者の臨床症状と電気生理学的検査を行い、末梢神経障害の程度を簡易総合神経障害スコア(reduced Total Neuropathy Score)に基づいて評価した。
結果:オメガ3不飽和脂肪酸を摂取した30人のうち21例(70%)は神経障害の発生を認めなかった。一方、コントロール群では神経障害の発生を認めなかったのは27人中11例(40.7%)であった。この発生頻度の差は統計的に有意であった(OR = 0.3, .95% CI =
(0.10-0.88), p = 0.029)。
末梢神経障害の程度には統計的有意差は認めなかったが、コントロール群(プラセボ群)の方が末梢神経障害の重症度は高い傾向にあった。
結論:オメガ3系不飽和脂肪酸は、パクリタキセルによる末梢神経障害の発生を防ぐための有効な神経保護剤である可能性が示唆された。乳がんの患者は抗がん剤の助けによって無再発生存期間がより長くなっている。パクリタキセルによる神経障害を軽減する方法は、患者の生活の質(QOL)を顕著に改善する効果が期待できる。
(訳者注)神経細胞や筋肉細胞は細胞分裂を行わないため、抗がん剤や放射線治療を受けても、ダメージを受けにくいと思われています。しかし、パクリタキセル(商品名タキソール)やドセタキセル(商品名タキソテール)などのタキサン製剤、ビンクリスチン(商品名オンコビン)やビノレルビン(商品名ナベルビン)などのビンカアルカロイド製剤、シスプラチン(商品名ランダなど)やカルボプラチン(商品名パラプラチン)やオキサリプラチン(商品名エルプラット)などの白金錯体製剤、プロテアソーム阻害剤のボルテゾミブ(商品名ベルケイド)では、高頻度に末梢神経障害による副作用(しびれや感覚障害や痛み)が発現します。この末梢神経障害の原因として、神経軸索の微小管の傷害や神経細胞の直接傷害などが関連しています。
微小管は細胞骨格を形成する蛋白質であり、チューブリンというタンパク質が集まった長い直径約25nmの管状構造をもっています。微小管は細胞内の蛋白質の輸送や細胞内小器官輸送のレールとして機能しており、細胞分裂の時の染色体の移動に必要です。つまり、細胞分裂する際に、複製されたDNAは染色体と呼ばれる構造に凝集し、細胞の両極へと引き寄せられ、等分されますが、このとく染色体を分裂した2つの細胞に分離する働きをするのが微小管です。
近年、抗がん剤の標的の一つとして微小管が注目されています。がん細胞が分裂する時に、チューブリンから微小管が形成される過程を阻害すれば、細胞分裂を防ぐことができるからです。
しかし、微小管の形成を阻害することは、細胞分裂の阻害だけでなく、神経障害の原因にもなります。神経の軸索(神経線維)は、神経細胞の細胞体から発する1本の長い突起で、他の神経細胞や筋肉に信号を伝達するケーブルのようなものです。軸索の中にある微小管は軸索の発育や物質の輸送に関連しています。神経軸索の中では、微小管は細胞体から神経軸索の先端に向かって伸びていて、微小管の上で、モータータンパク質の助けを借りて、神経軸索内でのタンパク質の輸送が行われます。
したがって、微小管をターゲットにする抗がん剤は、その副作用として神経細胞の軸索の働きを傷害し、神経の信号が正しく伝達出来なくなって、しびれや感覚障害や痛みなどの末梢神経障害の副作用を引き起こします。
タキサン系抗がん剤やビンカアルカロイド系抗がん剤は微小管を標的として作用することによりがん細胞の抑えるため、神経細胞の微小管も傷害され、神経障害を引き起こします。多くの場合、指先のしびれ感にはじまり、しだいに上の方に広がっていきます。進行すると筋力低下や歩行困難なども生じます。自律神経が障害されると便秘や排尿障害が起こることもあります。
またプラチナ製剤は、神経細胞に直接ダメージを与える結果、二次的に軸索障害をきたしていると考えられています。下肢やつま先のしびれに代表される感覚性の末梢神経障害が主に起こります。
末梢神経障害を起こると、日常生活において、服のボタンがとめにくくなる、つまづきやすくなる、手や足の先がしびれる、温度感覚が無くなる、味覚が変わるなど様々な症状が発生してきます。強い痛みを感じる場合もあります。聴力障害や耳鳴りが起こることもあります。
抗がん剤による神経障害はいったん発現すると有効な対策が少なく、不可逆的になる場合もあります。したがって、症状が強い場合には、抗がん剤治療の中断や薬剤の変更を余儀なくされます。がん患者が治療を早期に中止する最も多い理由の一つです。
パクリタキセルは乳がん、胃がん、卵巣がん、子宮体がん、非小細胞性肺がんに使われる抗がん剤で、末梢神経障害によって投与が困難になることが多い抗がん剤です。
パクリタキセルによる末梢神経障害を軽減するサプリメントとしてアセチル-L-カルニチンやαリポ酸、メラトニンなどがあります。これらにDHAやEPAを加えると効果を高めることができるかもしれません。
DHA/EPAが神経障害を緩和するメカニズムとして、炎症性サイトカインの産生を抑える抗炎症作用や、神経細胞の膜に取込まれることによって神経細胞の機能や修復を促進する作用などが指摘されています。
【原文】
BMC Cancer. 2012 Aug 15;12:355.
Omega-3
fatty acids are protective against paclitaxel-induced peripheral neuropathy: a
randomized double-blind placebo controlled trial.
Ghoreishi Z, Esfahani A, Djazayeri A, Djalali M, Golestan B, Ayromlou H, Hashemzade S, Asghari Jafarabadi M, Montazeri V, Keshavarz SA, Darabi M.
Source
Department of Nutrition and
Biochemistry, School of Health, Tehran University of Medical Sciences, Tehran,
Iran.
Abstract
BACKGROUND:
Axonal sensory peripheral
neuropathy is the major dose-limiting side effect of paclitaxel.Omega-3 fatty
acids have beneficial effects on neurological disorders from their effects on
neurons cells and inhibition of the formation of proinflammatory cytokines
involved in peripheral neuropathy.
METHODS:
This study was a randomized
double blind placebo controlled trial to investigate the efficacy of omega-3
fatty acids in reducing incidence and severity of paclitaxel-induced peripheral
neuropathy (PIPN). Eligible patients with breast cancer randomly assigned to
take omega-3 fatty acid pearls, 640 mg t.i.d during chemotherapy with
paclitaxel and one month after the end of the treatment or placebo. Clinical
and electrophysiological studies were performed before the onset of
chemotherapy and one month after cessation of therapy to evaluate PIPN based on
"reduced Total Neuropathy Score".
RESULTS:
Twenty one patients (70%) of the
group taking omega-3 fatty acid supplement (n = 30) did not develop PN while it
was 40.7%( 11 patients) in the placebo group(n = 27). A significant difference
was seen in PN incidence (OR = 0.3, .95% CI = (0.10-0.88), p = 0.029). There
was a non-significant trend for differences of PIPN severity between the two
study groups but the frequencies of PN in all scoring categories were higher in
the placebo group (0.95% CI = (-2.06 -0.02), p = 0.054).
CONCLUSIONS:
Omega-3 fatty acids may be an efficient
neuroprotective agent for prophylaxis against PIPN. Patients with breast cancer
have a longer disease free survival rate with the aid of therapeutical agents.
Finding a way to solve the disabling effects of PIPN would significantly
improve the patients' quality of life.